Как производят лекарства
То, что лекарства должны быть эффективными и безопасными, понятно всем. Государственные органы, разрешающие допуск лекарственных препаратов на рынок (регуляторы), следят, чтобы для новых лекарств были собраны убедительные доказательства, что польза от их применения перевешивает риск. Ещё один критерий, за которым не менее пристально следят регуляторы, качество лекарства. Оно обеспечивается в первую очередь соблюдением строгих норм производства и контроля. О том, как устроено современное производство лекарств, мы и поговорим.
Качество
Качество – интересная концепция. Интуитивно понятно, что это, но определение сходу даст не всякий. Кажется, что качество – это когда «продукт хороший». А что значит «хороший» в приложении к лекарствам? Хорошее лекарство делает то, что от него ожидают, то есть лечит человека или предотвращает заболевание. Вот мы и подобрались к регуляторному определению фармацевтического качества: это пригодность действующего вещества и лекарственного препарата для своего целевого назначения. С точки зрения производства качество неразрывно связано с эффективностью и безопасностью: если в лекарстве недостаточно действующего вещества, оно будет неэффективным, а если есть вредные примеси – небезопасным.
Для стандартизации подходов в наиболее развитых странах с 1990 годов началась разработка единой системы руководств ICH, в которую входит «библия» фармацевтических производителей – Надлежащая производственная практика (Good Manufacturing Practice, GMP). Она была принята в 1999 году и с тех пор регулярно обновляется. GMP устанавливает правила для каждой составляющей фармацевтического производства: персонала, процессов, помещения, документооборота, контроля входящих материалов, продукта и т. д. Такая система обеспечения качества позволяет не только снизить риски при разработке новых препаратов, но и упростить взаимодействие между всеми сторонами, соблюдающими GMP. Скажем, если производственная площадка соблюдает правила GMP и регулярно проходит инспекции, нет необходимости контролировать каждую партию выпускаемого ей лекарства в отдельности.
На словах довольно просто, но на деле это выливается в сложную систему мероприятий по организации производства лекарства и контроля его качества. Погрузимся в неё подробнее и вернемся на шаг назад – к разработке.
Фармацевтическая разработка
При создании нового лекарства его пробные образцы производят в лаборатории в небольших количествах, достаточных для экспериментов на клетках и животных. В будущем же потребуется перейти к в промышленным масштабам (если, конечно, лекарство не провалится по дороге в доклинических или клинических исследованиях). Для этого исследователи на самом раннем этапе продумывают, как они будут масштабировать производство нового лекарства и контролировать его качество.
Итак, в ходе фармацевтической разработки происходит постепенный переход от синтеза лекарств в лаборатории «вручную» ко всё большим масштабам – сначала пилотным, для клинических исследований, потом к промышленным, для широкого применения (рис. 1). Часто оказывается, что лабораторные методы производства совсем не годятся для крупномасштабного производства, и их приходится менять, а то и придумывать новые. Получается, что фармацевтическая разработка – это тоже научный поиск, хотя за многие годы ученые наработали довольно много стандартных методов получения, очистки и контроля веществ.

Рис. 1. Фармацевтическая разработка идет параллельно доклинической и клинической. По мере того, как лекарство применяется у всё большего круга людей, растут риски, а значит и требования к обеспечению качества. ТТ – технологический трансфер. Источник
Параллельно с методами получения и очистки (главными этапами производства) идет разработка методов анализа полученных продуктов и примесей. Они тоже трансформируются по мере продвижения лекарства к пациенту. Когда продукт готов к выходу на рынок, очень важной становится валидация процессов производства и методов контроля. Валидация – это доказательство того, что процесс или метод приводит к желаемому результату.
Наконец, к моменту окончания регистрационных клинических исследований в ходе фармацевтической разработки должны быть собраны всесторонние сведения и о действующем веществе, и о готовой лекарственной форме: их физико-химические характеристики, условия процессов производства, допустимые диапазоны колебаний, профиль примесей и т. д. Обязательно проводятся исследования лекарств на стабильность при хранении, чтобы определить срок годности. На основании этих исследований составляются спецификации – список испытаний, методов исследования и критериев приемлемости. Всё это передается регулятору в составе регистрационного досье, включающего также результаты доклинических и клинических исследований. При необходимости регулятор проводит инспекцию производственных площадок и решает, можно ли допустить лекарство к широкому использованию.
Так как всё-таки производят лекарства?
По большому счёту, все лекарства делятся на два типа: низкомолекулярные (так называемая «химия») и биологические. Обычно низкомолекулярные вещества состоят из нескольких десятков атомов, биологические – нескольких десятков или даже сотен тысяч (рис. 2). Сложность структуры напрямую влияет на сложность производства.
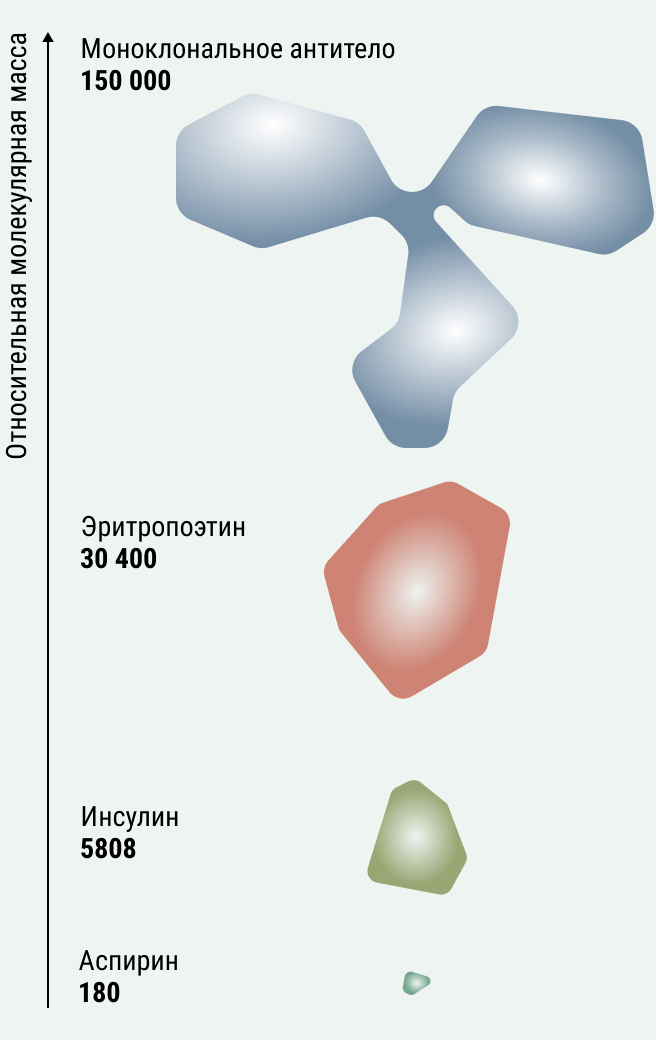
Рисунок 2. Сравнение размера и молекулярных масс различных лекарств: аспирина, гормонов инсулина и эритропоэтина и моноклонального антитела. Источник
Низкомолекулярные препараты производить проще. Часто их получают методом химического синтеза, иногда выделяют из природного сырья (например, растительного) или получают в биореакторах. В отдельных случаях эти методы сочетают: выделяют природное сырье, а затем изменяют молекулы синтетическим путем. Так производят некоторые антибиотики: их структура очень сложная и синтез основной части проще отдать на откуп живым организмам (например, грибам).
Затем полученный промежуточный продукт очищают, добавляют вспомогательные вещества и готовят лекарственную форму. Важно, что небольшое количество атомов в структуре позволяет проконтролировать, нужное ли получилось вещество, даже если его произвели на другом заводе. Именно поэтому для малых молекул возможно производство дженериков – аналогов оригинальных препаратов, на которые закончилась патентная защита.
Производство биологических препаратов намного сложнее. В организме человека развитие заболеваний запускается на молекулярном уровне – чаще всего в нем задействованы белки (молекулярные мишени), играющие первостепенную роль в структуре и функциях клетки. Воздействовать на молекулярную мишень эффективнее всего также с помощью белка. Когда и мишень, и лекарство - большие молекулы, то площадь контакта между ними больше. Значит, лекарственному веществу легче связаться с мишенью и воздействовать на нее (рис. 3). (Для наглядности: замазать черный квадрат Малевича проще всего с помощью… красного квадрата Малевича)
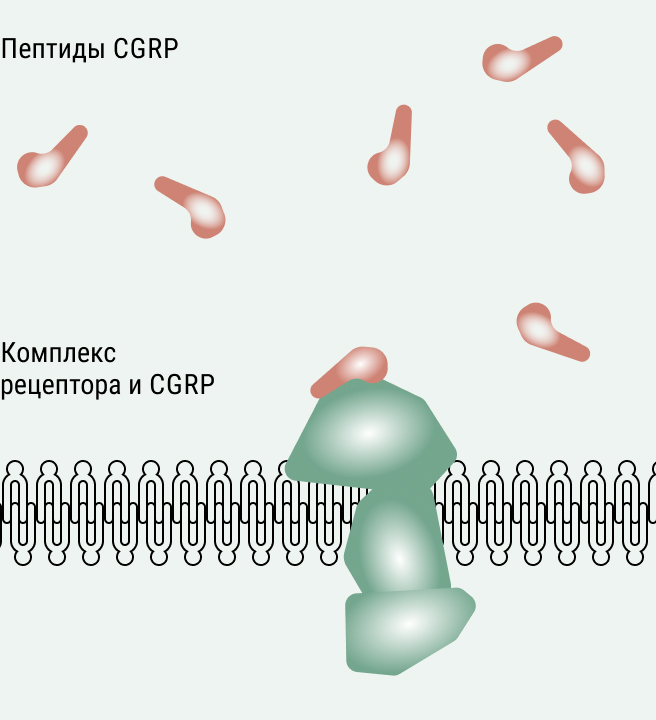
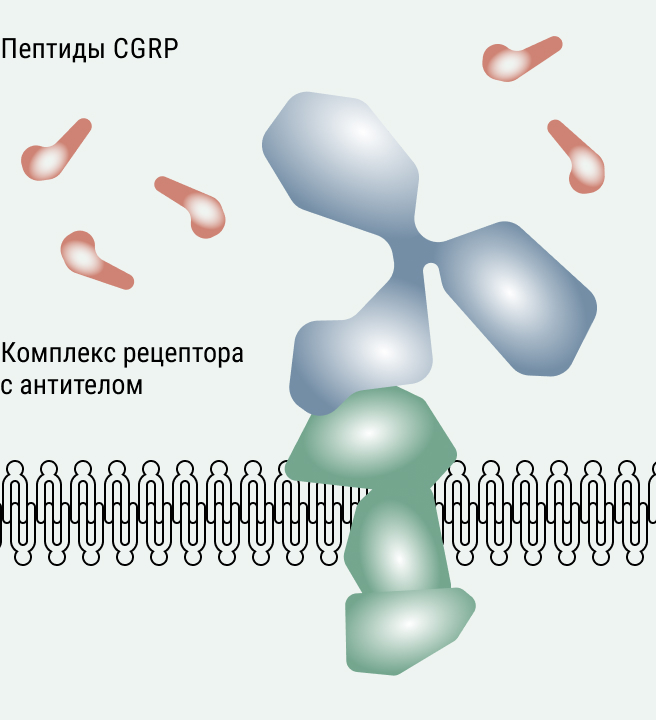
Рисунок 3. Слева: пептид CGRP связывается с рецептором (CGRP receptor complex) – это один из механизмов развития мигрени. Справа: антитело (показано синим) связывается с рецептором и блокирует его, тем самым помогая справиться с мигренью. Источник
Но синтезировать такие сложные структуры как белки способны только более сложные структуры - живые клетки, в которых подобные процессы происходят каждую секунду. Получить эти клетки – отдельная непростая задача. Для этого берут ген, кодирующий нужный белок, и методами генной инженерии вставляют его в клетки. Ген может вставиться по-разному, поэтому клетки размножают и отбирают потомство (оно называется «клон»), которое производит больше всего правильного белка. Его изучают, замораживают и затем используют как исходный клон для размножения.
Биопрепараты обычно производят в биореакторах, или ферментерах – больших баках объемом 50-1000 л. Туда загружают клетки и питательные вещества, а через некоторое время собирают «урожай». Очистка биопрепаратов – непростое дело, ведь нужно освободиться от клеточных и вирусных примесей, «неправильных» молекул и оставить только нужный продукт. Из-за капризов живых клеток продукт получается всегда немного разный, он сильно зависит от процесса. Даже говорят, что для биопрепаратов «продукт есть процесс».
Изучение свойств биопрепаратов напоминает притчу о слепых, которые ощупывали слона, и спорили, что это перед ними (рис. 4). Только множество методов в совокупности позволяют более-менее полно охарактеризовать биопродукт. Поэтому дженерики биопрепаратов создать невозможно, и речь идет о биовоспроизведённых препаратах. Для биовоспроизведённых препаратов нужно суметь доказать, что при изменении производства параметры качества, а значит, эффективности и безопасности не изменились.
Рис. 4. Слепые ощупывают слона, и их мнения расходятся. Источник
В последнее время из биологических препаратов отдельно выделяют генные и клеточные. С ними дело обстоит ещё сложнее. Так, генотерапевтические препараты часто представляют собой целые терапевтические вирусы, куда входит множество белков и нуклеиновых кислот, а клеточные продукты – это живые клетки. И производить, и обеспечивать стабильное качество для них безумно сложно, но человечество уже справляется и с этим.
Для упрощения и наглядности сравним производство лекарств с производством средств передвижения. Мы получим «низкомолекулярный» велосипед, «биологический» автомобиль и «генотерапевтический» самолет. Впрочем, для развития доступной гражданской авиации человечеству понадобилось менее полувека. Будем надеяться, что и массовое производство доступных генотерапевтических препаратов не за горами.




